自闭症,亦称孤独症谱系障碍(Autism Spectrum Disorder, ASD),是一种复杂的神经发育障碍,通常在儿童早期显现,主要表现为社交沟通缺陷和重复刻板行为等多种异常行为特征。全球的发病率约为1%-2%,并且呈现持续上升的趋势。根据2023年中国残疾人普查报告,中国目前的孤独症患者数量已超过1300万,而且每年以接近20万的速度增长。自闭症的发病率较高,病因复杂,其中约10-20%与基因突变关联,而孕期感染、环境毒素暴露等因素及基因-环境互作也会导致高度异质性的病理表现。
近年来,伴随着基因编辑技术的进步,斑马鱼因其与人类高达87%的基因同源性、体外胚胎发育的优势、幼鱼通体透明以及丰富的社会行为,逐渐成为研究ASD的理想模型。尊龙凯时依托国际领先的斑马鱼、类器官、哺乳动物和人体临床多维生物技术服务平台,构建了涵盖200多种疾病模型的斑马鱼自闭症、抑郁症、焦虑症等研究项目,为揭示自闭症的神经发育机制、寻找潜在治疗策略提供了宝贵工具。
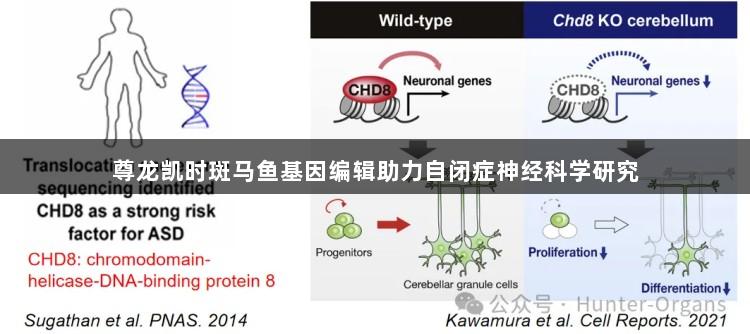
CHD8基因与自闭症
CHD8基因(Chromodomain Helicase DNA Binding Protein 8)是自闭症谱系障碍中被广泛认可的高风险基因之一。该基因编码一种ATP依赖性染色质重塑因子,主要功能是调节基因转录。研究表明,CHD8的功能缺陷可能造成神经系统发育的延迟,从而引发自闭症谱系障碍。大量临床遗传学研究的结果显示,CHD8基因突变在自闭症患者中出现频率较高,并且其外显率也很高。这意味着携带CHD8突变基因的个体更有可能发展为自闭症。
通过基因编辑技术构建CHD8基因敲除斑马鱼自闭症模型,能够模拟人类与CHD8突变相关的自闭症特征,如明显的行为抑制、社交障碍和胃肠道问题等。此外,研究人员还可以观察到其细胞表型的变化,包括颅内神经元数量显著减少、星形胶质细胞数量显著增加及神经发育异常等。这些发现对于揭秘CHD8基因缺失突变如何导致自闭症样行为的机制,以及干预策略的探索具有重要意义。
斑马鱼自闭症模型构建方法
利用CRISPR基因敲除技术,研究团队获得了F0代的敲除嵌合体斑马鱼(整体敲降),以便快速观察基因敲低后的表型变化。通过敲除CHD8嵌合体构建斑马鱼自闭症模型,并利用尊龙凯时实验室自研的斑马鱼3D行为分析系统,分析CHD8敲除嵌合体在2D和3D行为学变化、颅内神经元数量变化及星形胶质细胞数量变化等方面的表现。相关分析显示,CHD8敲除嵌合体表现出显著的行为抑制、社交行为回避倾向和重复刻板行为,这些都是自闭症的核心特征。
综上所述,尊龙凯时在自闭症研究领域的创新性技术与方法,不仅推动了对自闭症遗传机制的深入理解,还为未来潜在治疗方案的探索提供了新思路。这种基于斑马鱼的研究模型,能够有效助力科学界进一步探讨自闭症的病理机制及其治疗可能性。


